| Главная |
БиохимияСвойства ферментов Ферменты обладают всеми свойствами белков. Однако по сравнению с белками, выполняющими другие функции в клетке, ферменты имеют ряд специфических, присущих только им свойств. Зависимость активности ферментов от температуры. Температура может влиять по-разному на активность фермента. При высоких значениях температуры может происходить денатурация белковой части фермента, что негативно сказывается на его активности. При определенных (оптимальных) значениях температура может влиять на скорость образования фермент-субстратного комплекса, вызывая увеличение скорости реакции. Температура, при которой каталитическая активность фермента максимальна, называется температурным оптимумом фермента. Различные клеточные ферменты имеют собственные температурные оптимумы, которые определяются экспериментально. Для ферментов животного происхождения температурный оптимум находится в интервале 40 - 50°С (рис. 8). 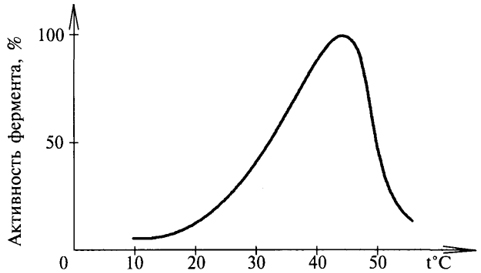 Рис. 8. Влияние температуры на активность фермента Зависимость активности фермента от рН-среды. Большинство ферментов проявляет максимальную активность при значениях рН, близких к нейтральным. Лишь отдельные ферменты "работают" в сильно кислой или сильно щелочной среде. Например, активность пепсина - фермента, гидролизующего белки в желудке, - максимальна при рН 1,5 - 2,5. В щелочной среде "работают" ферменты, локализованные в кишечнике. Изменение оптимального для данного фермента значения рН-среды может привести к изменению третичной стурктуры фермента, что скажется на его активности. С другой стороны, при изменении рН может измениться 51 ионизация субстрата, что повлияет на образование фермент-субстратного комплекса. Влияние рН-среды на активность фермента показано на рисунке 9. 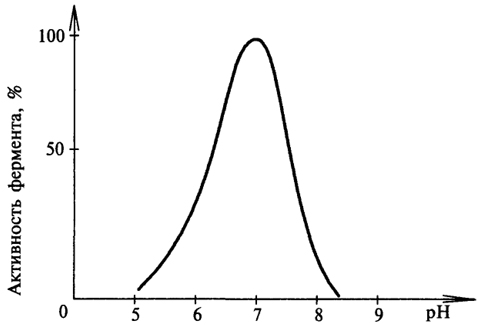 Рис. 9. Влияние рН-среды на активность фермента Специфичность действия ферментов - одно из главных их свойств. Специфичность - это избирательность фермента по отношению к субстрату (или субстратам). Специфичность действия ферментов объясняется тем, что субстрат должен подходить к активному центру как "ключ к замку". Это образное сравнение сделано Э.Фишером в 1894 г. Он рассматривал фермент как жесткую структуру, активный центр которой представляет собой "слепок" субстрата. Однако этой гипотезой трудно объяснить групповую специфичность ферментов, т.к. конфигурация "ключей" (субстратов), подходящих к одному "замку", слишком разнообразна. Такое несоответствие получило объяснение в 50-е гг. XX в. в гипотезе Д. Кошланда. Она получила название гипотезы "вынужденного соответствия". По гипотезе Д. Кошланда, молекула фермента не жесткая, а гибкая, эластичная, поэтому информация фермента и его активного центра может изменяться при присоединении субстрата или других лигандов. В момент присоединения (рис. 10) субстрат "вынуждает" активный центр фермента принять соответствующую форму. Это можно сравнить с "перчаткой" и "рукой". Гипотеза "вынужденного соответствия" получила экспериментальное подтверждение. Эта гипотеза позволяет также объяснить причину превращения близких аналогов субстратов. 52 Различают несколько видов специфичности.
Влияние на активность ферментов активаторов и ингибиторов. К числу факторов, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg2+, Mn2+, Zn2+, K+ и Со2+, а из анионов - Сl-. Катионы действуют на ферменты по-разному. В одних случаях они облегчают образование фермент-субстратного комплекса, в других - способствуют присоединению кофермента к апоферменту, либо присоединяются к аллостерическому центру фермента и изменяют его третичную структуру, в результате чего субстратный и каталитический центры приобретают наиболее выгодную для осуществления катализа конфигурацию. Ингибиторы тормозят действие ферментов. Ингибиторами могут быть как эндогенные, так и экзогенные вещества. Механизмы ингибирующего действия различных химических соединений разнообразны. 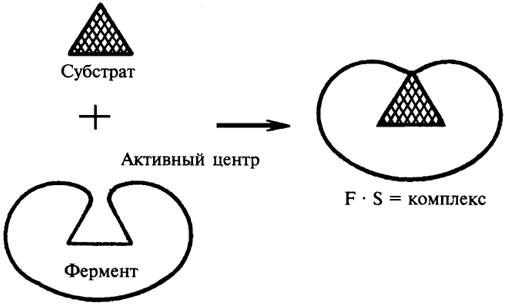 Рис. 10. Взаимодействие субстрата с ферментом согласно модели "вынужденного соответствия" 53 |